近日,药物化学权威期刊European Journal of Medicinal Chemistry (IF = 7.088)发表沈阳药科大学制药工程学院赵燕芳/宫平课题组在新型ATR抑制剂研究领域的最新成果,文章题目为“Discovery of novel 7,7-dimethyl-6,7-dihydro-5H-pyrrolo[3,4-d]pyrimidines as ATR inhibitors based on structure-based drug design”。
共济失调毛细血管扩张突变基因和Rad3相关蛋白(Ataxia telangiectasia mutated and Rad3-Related kinase, ATR)属于丝氨酸-苏氨酸激酶,是磷脂酰肌醇3-激酶(PIKK)家族成员之一,是DNA损伤反应(DNA damaging response, DDR)和DNA修复通路的关键激酶之一。ATR激酶主要针对DNA单链(Single-stranded DNA, ssDNA)产生应激,对复制细胞的生存能力至关重要。ATR抑制剂以CHK1的磷酸化对复制应激进行反应,使其在S、G2和M期触发细胞周期阻滞,从而抑制由ATR激酶介导的修复通路,高效杀死肿瘤细胞。
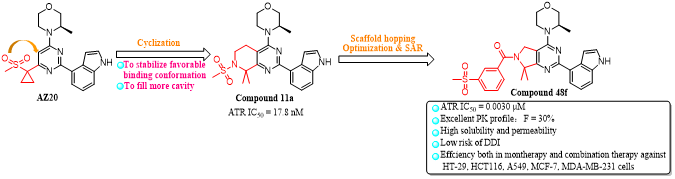
沈阳药科大学赵燕芳/宫平课题组采用基于结构的药物设计策略,以AZ20为先导化合物,通过环合策略、骨架跃迁策略和多轮结构优化,得到了一系列四氢吡啶并嘧啶类衍生物,进一步优化得到了7,7-二甲基-6,7-二氢-5H-吡咯并[3,4-d]嘧啶类衍生物,其中化合物48f对ATR具有优异的抑制活性(IC50= 3 nM),对ATM缺陷的细胞LoVo (IC50= 0.092 μM)、SW620 (IC50= 0.145 μM)、OVCAR-3 (IC50= 0.127 μM)具有显著的抗增殖活性,与AZD-1390、顺铂、奥沙利铂、奥拉帕尼联用具有协同作用,优于阳性对照AZ20。化合物48f以浓度依赖性抑制LoVo细胞的克隆和迁移,且具有良好的药代动力学性质(F = 30%, SD rat)、可接受的PPB (Human: 99.7%, M. fascicularis: 92.1%, Beagle: 97.8%, Rat: 96.1%, and Mouse: 97.6%)和低的药物-药物相互作用风险(CYP1A2:IC50>10 μM, CYP2C9:IC50= 10 μM, CYP2C19:IC50= 1 μM, CYP2D6:IC50> 10 μM, CYP3A4-M:IC50= 1 μM, CYP3A4-T:IC50= 10 μM)。
文章第一作者为沈阳药科大学2020级药物化学博士研究生齐银良,沈阳药科大学制药工程学院赵燕芳教授、侯云雷副教授为本文共同通讯作者。
文章链接:https://www.sciencedirect.com/science/article/pii/S0223523422008479
文章DOI:https://doi.org/10.1016/j.ejmech.2022.114945